Biosimilar intercambiable
Descubra Semglee®: El primer biosimilar intercambiable de la insulina glargina aprobado por la FDA.
Semglee® es el primer producto biosimilar intercambiable de insulina glargina aprobado en EE.UU. por la FDA, y está indicado como tratamiento para mejorar el control glucémico de los pacientes con DMT1 y DMT2.
Acerca de Semglee®
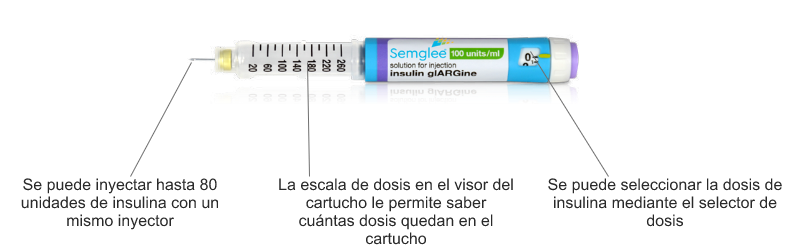
Semglee® es un nuevo tratamiento que existe en la región para sus pacientes con diabetes tipo 1 y tipo 2, ayuda a reducir los niveles de HbA1c y a controlar los de glucemia, además brinda flexibilidad en la dosificación y permite hasta 80 unidades de insulina con una sola inyección.
Semglee® es un biosimilar intercambiable con la insulina glargina de referencia, es una alternativa médica efectiva, segura y de alta calidad. Semglee es una insulina de 100 U/ml, análoga de una sola aplicación diaria, con acción prolongada, de 3 ml de solución que contiene 300 U.I. (Unidades Internacionales).
Semglee® es una solución para necesidades médicas no cubiertas
La diabetes es una enfermedad que va en aumento a nivel mundial, particularmente la de tipo 2, por esta razón se estima que para el año 2045 la cantidad de adultos alrededor del mundo con esta condición médica alcanzará los 629 millones, implicando así una gran presión financiera para los sistemas de atención de la salud, que para poder enfrentar la creciente demanda, buscan constantemente nuevas alternativas para suministrar medicamentos de alta calidad, y al mismo tiempo aumentar la asequibilidad y reducir los gastos de los pacientes.
Semglee® es una alternativa para que sus pacientes dependientes de la insulina de referencia puedan reducir el costo del tratamiento médico, es una opción de alta calidad, segura y mayormente rentable para el tratamiento de DMT1 y DMT2.
Semglee® es el acceso para sus pacientes a un producto efectivo con un valor económico potencialmente menor y que ofrece beneficios clínicos comprobados, semejantes al producto de referencia.

¿Qué es un biosimilar?
Semglee® pertenece al grupo de medicamentos llamado biosimilares, es decir biológicos equivalentes en calidad, eficacia y seguridad a un medicamento original, llamado de referencia.
Los medicamentos biosimilares deben ser aprobados por la FDA para que puedan ser considerados como intercambiables con el tratamiento de referencia, por lo cual deben contar con rigurosos estudios que puedan comprobar su calidad, seguridad y efectividad.
A diferencia de los medicamentos genéricos, que se producen a partir de pequeñas moléculas que pueden replicarse y ser bioequivalentes, los biosimilares son compuestos por moléculas más grandes, complejas y que se obtienen de células vivas, el objetivo es ser semejante al medicamento de referencia, sin diferencias clínicamente significativas.
Semglee® es una alternativa a la insulina de referencia, de alta calidad y potencialmente rentable económicamente para sus pacientes con alteraciones de la glucemia.
Durante el proceso de desarrollo de Semglee® se llevaron a cabo varios estudios para poder obtener la aprobación de la FDA.
Proceso de aprobación de los biosimilares
Datos Farmacocinéticos (PK) y Datos Farmacodinámicos (PD)
INSTRIDE 1 – Eficacia clínica comprobada en pacientes con diabetes de tipo 1
INSTRIDE 2 – Eficacia clínica comprobada en pacientes con diabetes de tipo 2
INSTRIDE 3 – Extensión del estudio INSTRIDE para evidenciar seguridad
FDA Administración de Medicamentos y Alimentos. (28 de julio, 2021). La FDA aprueba el primer producto de insulina biosimilar intercambiable para el tratamiento de la diabetes. https://www.fda.gov/news-events/press-announcements/la-fda-aprueba-el-primer-producto-de-insulina-biosimilar-intercambiable-para-el-tratamiento-de-la
Semglee® se administra mediante un inyector precargado fácil de usar
Semglee® se administra con un inyector precargado con insulina glargina (U 100), es fácil de usar y está diseñado para que sus pacientes lo puedan utilizar en múltiples inyecciones subcutáneas con agujas desechables, una vez al día durante varios días, hasta utilizar todo el contenido.

La aprobación de Semglee® como biosimilar intercambiable significa
un potencial ahorro anual en el tratamiento médico de sus pacientes.
Semglee® ha sido aprobado en EE.UU. por la FDA como el primer producto biosimilar intercambiable de la insulina glargina U 100, donde normalmente este tipo de medicamentos tienen un valor inicial entre un 15% y un 35% más bajo que los precios de lista comparativos de los productos de referencia, por lo tanto, es una alternativa que potencialmente ayudará a disminuir el costo del tratamiento médico de sus pacientes con DMT1 y DMT2.
* Dato original expresado en euros.
* Tasa de conversión usada: €1.00 equivale a $1.13 dólar
NHS Commissioning Support. Toolkit for implementing best value adalimumab, actualizado en agosto de 2018. NHS Specialist Pharmacist Service. Disponible en: www.sps.nhs.uk/articles/adalimumab-toolkit-for-commissioners-and-providers/ (accessed 19 October 2018)
Conozca más información técnica de Semglee
como tratamiento alternativo para mejorar el control glucémico de los pacientes con DMT1 y DMT2.
